Le persone che vengono in visita al CERN spesso chiedono “a che serve” la ricerca che facciamo e se abbia delle “applicazioni pratiche”.
La risposta alla seconda domanda è: sì le tecnologie ed i metodi che sviluppiamo per portare avanti la nostra ricerca hanno molte applicazioni pratiche. Anche se il nostro scopo è solo spingere avanti la frontiera della conoscenza scientifica, storicamente si può vedere che la ricaduta tecnologica è sempre stata molto forte.
Ciò che in un secolo è speculazione teorica nel secolo successivo diventa spesso tecnologia ed economia. Si pensi al Web, inventato al CERN negli anni ’90 e una volta reso “open source” ha rivoluzionato il modo di comunicare ed ha creato un intero settore economico.
La ricerca per la cura dei tumori
Per discutere di trasferimento tecnologico dalla ricerca all’industria occorre un articolo a parte. Qui vorrei soffermarmi su un aspetto particolare quello della adroterapia. Visto che sapete tutto sulle radiazioni ionizzanti siete pronti a capire come funziona questo tipo avanzato di terapia oncologica.
Questa tecnica è finalizzata alla cura di tumori profondi e non operabili: esempi possono essere tumori cerebrali o del bulbo oculare ma sfortunatamente ce ne sono molti altri. Prima di iniziare scordatevi la chemioterapia: non ha nulla a che vedere con quello che stiamo per studiare ora.
La chemioterapia si basa sull’assunzione (iniezione o per via orale) di farmaci in grado di distruggere le cellule tumorali attraverso vie metaboliche. I progressi in questo campo sono continui e l’azione dei radio-farmaci è sempre più mirata ma queste sostanze hanno un grado di tossicità anche per le cellule sane.
La radioterapia ci interessa di più: consiste nello sparare un fascio di Raggi X (ormai sapete onde elettromagnetiche di frequenza molto superiore a quelle della luce visibile e anche dell’ultravioletto) nella zona dove è presente il tumore.
Sappiamo che i raggi X sono onde EM pacchettizzate (particelle di luce, fotoni) di alta energia e decisamente ionizzanti: danneggiano le cellule e sono in grado di ucciderle. Quello che si vuol fare quindi è spararli sul tumore, ma la cosa non è semplicissima.
Guardate come è fatta la macchina: il “cannone” che spara i Raggi X è in grado di ruotare attorno al bersaglio (che in questo caso è la testa del paziente). Il motivo è che i Raggi X che attraversano la testa del paziente colpiscono indifferentemente sia le cellule sane che quelle malate.
Il passaggio dei Raggi X attraverso il corpo del paziente ionizza (danneggia) oltre al tumore tutti gli altri tessuti: quelli davanti al tumore e quelli dietro. Ruotando il cannone si riesce ad accumulare dose (danno cellulare) nella zone dove è presente il tumore “risparmiando” un po’ le zone sane.
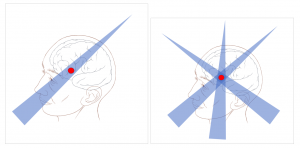
Capite che non è proprio una cosa bellissima: comunque irriadiamo zone che non hanno bisogno di essere irradiate, ma non possiamo far altro con i Raggi X perché non avendo carica elettrica (sono luce) il loro rilascio di energia segue delle leggi ben precise.
Per essere più efficienti dobbiamo usare qualche altro tipo di particella: qualcosa come una bomba di profondità che esploda nella zona dove è il sommergibile nemico. Questo effetto si può ottenere usando particelle come protoni o ioni di carbonio. Particelle elettricamente cariche.
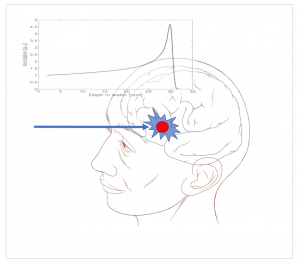
La ionizzazione nel caso dei protoni segue un andamento diverso. Se si aggiustano opportunamente i parametri del fascio incidente si riesce a fare in modo che quasi tutta la dose venga scaricata nel punto esatto dove c’è il tumore e praticamente nulla finisca nei tessuti sani.
Quindi vediamo come l’adroterapia permette di irradiare i tumori profondi seguendone il volume con precisione micrometrica e di risparmiare al massimo i tessuti circostanti. Sicuramente abbiamo fatto un passo in avanti rispetto ai poco precisi Raggi X.
Ma possiamo fare di meglio?
Nella pratica le cose sono sempre complicate: infatti il rilascio di dose ionizzante da parte del fascio di particelle nel tessuto del paziente è altamente sensibile a variazioni di diverso genere.
Per prima cosa per mirare al tumore bisogna avere immagini diagnostiche da tomografia computerizzata che possono essere distorte. Ricordate che stiamo sparando un fascio di protoni nella testa di una persona: il margine di errore è quasi nullo.
Poi ci possono essere variazioni morfologiche degli organi nell’intervallo di tempo compreso tra le varie sedute di trattamento. Oppure il paziente è mal posizionato. Infine gli organi non sono incollati e si possono spostare leggermente durante il trattamento.
La cosa migliore in assoluto sarebbe avere un sistema che permetta di correggere per tutte queste incertezze in tempo reale. Un sistema di sensori. Magari sensori altamente integrati, monolitici… Vi suona qualcosa ?
Se avessimo un monitor online potremmo velocemente focalizzare il fascio di particelle sul bersaglio (tumore) e scaricare su di esso la maggior parte dell’energia minimizzando ulteriormente l’irradiazione di tessuti sani compensando anche gli effetti che ho descritto sopra. Il monitor in tempo reale funziona rivelando la radiazione secondaria emessa a causa delle interazioni di natura nucleare tra fascio protoni incidente ed i tessuti. La radiazione secondaria è composta di varie particelle come fotoni, positroni e altre particelle cariche.
Noi interessiamo solo io fotoni. Ricordate sono fotoni emessi quando il fascio primario di protoni passa attraverso i tessuti. I fotoni sono utili perché l’emissione è istantanea e ricordate che noi vogliamo mirare velocemente al tumore e non stare lì a smanettare e “provare”.
L’emissione di fotoni dai tessuti mano a mano che il fascio di protoni penetra fino al tumore è molto piccola ed è di natura statistica: quindi per rivelare questi fotoni (che ci dicono DOVE STIAMO COLPENDO) occorrono sensori di piccola dimensione ma molto efficienti.
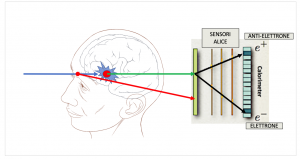
La figura mostra come funziona il monitor in tempo reale. Il fascio di protoni viene puntato sul tumore ed il puntamento aggiustato online rivelando i fotoni emessi mano a mano che i protoni attraversano il tessuto. Per prima cosa i fotoni vengono convertiti in coppie elettrone – antielettrone.
Infatti, i sensori di ALICE vedono gli elettroni anche meglio dei fotoni. Aiutandoci con dei calcoli siamo in grado di capire quali sono i fotoni “giusti” (in verde) ossia prodotti da protoni sparati sul tumore e quelli “sbagliati” e andare quindi ad aggiustare istantaneamente la mira.
I sensori a pixel CMOS ALPIDE sono perfetti per questo scopo perché sono efficienti anche se molto sottili ed il fatto di essere monolitici (MAPS, Monolithic Active Pixel Sensor) li rende compatti perché significa che il sensore incorpora anche l’elettronica necessaria alla digitalizzazione del segnale.

NOTA: Il dispositivo funziona producendo e rivelando antimateria (gli anti-elettroni o positroni). Una cosa simile accade con la PET (Positron Emission Tomography) che tutti credo conoscano. In quel caso i positroni vengono prodotti nel corpo del paziente da un radio-farmaco.
Essendo antimateria appena prodotti hanno una probabilità altissima di incontrare un elettrone negli atomi dei tessuti. Elettrone e positrone si annichilano producendo un lampo caratteristico di energia (raggi gamma) che vengono poi rivelati da un appartato molto simile a quelli del CERN.








Facebook Comments